在高中化学中,计算题的主要功能是考查考生掌握基础知识的广度和熟练程度以及知识的系统性。这类题目考查的形式既有直接的简单化学计算和间接的应用化学原理推算,常见的方法有假设法、关系式法、差量法、守恒法等。
化学反应图像题的特征是将一些关键的信息以图像、图表的形式给出,把题目中的化学原理抽象为数学问题,目的是考查考生从图像、图表中获得信息、处理和应用相关信息的能力以及对图像、图表的数学意义和化学意义之间对应关系的转换运用能力。
实验仪器的创新使用一般体现为三个“一”:一个装置的多种用途、一种用途的多种装置和一种仪器的多种用法,该类试题主要考查考生的思维发散能力。
所谓假设法,就是假设具有某一条件,推得一个结论,将这个结论与实际情况相对比,进行合理判断,从而确定正确选项。
主要应用:(1)判断混合物的组成。把混合物看成由某组分构成的物进行计算,求出最大值、最小值,再进行讨论。(2)判断可应中某个量的关系。把可应看作向左或向右进行到底的情况。(3)判断可应体系中气体的平均相对质量大小的变化。把可应看成向左或向右进行的单一反应。(4)判断生成物的组成。把多个平行反应看作单一反应。
状态假设法是指在分析或解决问题时,根据需要,虚拟出能方便解题的中间状态,并以此为中介,实现由条件向结论的思维方法。该方法常在化学平衡的计算中使用。
过程假设法是指将复杂的变化过程假设为(或等效为)若干个简单的、便于分析和比较的过程,考虑等效状态的量与需求量之间的关系,进而求解的方法。该方法在等效平衡的计算中使用概率非常高。
变向假设法指在解题时根据需要改变研究问题的条件或结论,从一个新的角度来分析问题,进而迁移到需要解决的问题上来,从而得到正确的答案。
在多步反应中,关系式法可以把始态的反应物与终态的生成物之间的“物质的量”关系表示出来,把多步计算简化成一步计算。正确书写关系式是用关系式化学计算题的前提。
适用于多步连续反应或循环反应。方法:将其中几个有关联的化学反应方程式进行适当变形(改变化学计量数),然后相加,消去中间产物,即得总的化学反应方程式。
(2)确定是否能用差量法:分析差值与始态量或终态量之间是否存在比例关系,以确定是否能用差量法。
“守恒法”利用物质变化过程中某一特定的量固定不变来列式求解。它的优点是用宏观的统揽全局的方式列式,不去探求某些细枝末节,直接抓住其中特有的守恒关系,快速建立算式,简捷巧妙地解答题目。常用的方法有质量守恒、得失电子守恒、电荷守恒等。
依据:反应前后参加反应的离子所带的电荷总量不变(或在电解质溶液中阴、阳离子所带的负、正电荷总数相等)。
方法:首先要确定体系,并找出体系中阴、阳离子的种类,每个离子所带的电荷数及其物质的量;然后根据阴、阳离子所带的电荷总数相等列出计算式。
考查知识点:根据图像考查反应发生的先后顺序、书写离子反应方程式、分析溶液的成分、离子的共存与推断、计算反应物的量或由离子反应画出相应的图像等。
溶液中存在多种还原剂(或氧化剂),加入同一种氧化剂(或还原剂)时,必须按照“强者先行”的原则,考虑反应的先后顺序。只有当“强”的反应完后,“弱”的才能发生反应。
离子共存图像要谨防离子共存的陷阱,特别要注意一些隐含条件和隐性关系;离子计算的前提是掌握离子反应方程式的书写,特别要注意物质间量的关系,遵循三大守恒原则和溶液电中性原则。
化学平衡图像是中学化学基础图像知识的一个重要方面,它能把抽象的化学平衡理论形象直观地表述出来。化学平衡图像题是高考必考题型之一,根据图像坐标表示的意义,将常考的化学平衡图像分成如下三类。
图像中的纵、横轴分别代表物质的数量(如浓度、百分含量、率、产率等)与反应时间(过程),将可应中物质的数量随时间的变化体现在图像中。
该类题解答时要明确曲线“走势”代表的意义,并由此确定反应进行的方向,再进一步确定改变的条件。千万要注意此类图像中可能出现的“交点”并不代表平衡点,只有某种量值不随时间改变时的点才是平衡点。
将物质或反应体系的某种量值与温度、压强、浓度、催化剂中的某一种之间的关系,反映在图像中。解答时首先要仔细观察图像,找出相关量值间的变化关系,然后将图像中的这种对应关系与理论知识进行对照,分析其是否符合理论上推导出来的关系,最后确定答案。
该类图像反映的是某一物质的量值(如浓度、率、产率、百分含量等)与一种或两种条件(温度、压强、催化剂)随时间的变化关系。其图像构成的特征是图像中有一表明反应已达到平衡的突变点(平衡点、最大值、最小值)。
解题思:依建立平衡所需时间的长短→反应速率的相对大小(时间短速率大)→确定影响反应速率的不同条件间的关系(反应速率大条件强)→再根据物质量值的变化判断平衡的移动方向,由此得出的移动方向应与由勒夏特列原理确定的方向一致。
近年高考中对电化学的考查出现了新的变化,以装置图为载体来考查电化学的相关知识,成为近年高考的新亮点。
原电池与电解池可以相互,利用这一原理可以制造二次电池。二次电池中,放电时是原电池,充电时是电解池,放电时的负极反应与充电时的阴极反应相反,放电时的正极反应与充电时的阳极反应相反。
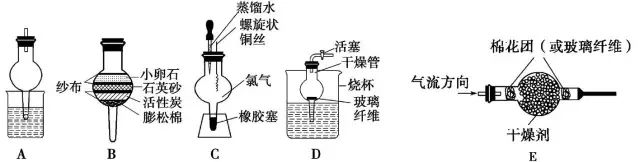
2.B装置为简易的过滤器,可净化天然水。如果去掉上边两层,可用活性炭对液体中的色素进行吸附。
3.C装置是一微型反应器。该装置既可节约药品,又可防止污染。如铜丝在该装置中燃烧时,Cl2封闭在干燥管内,实验结束后剩余的Cl2不仅可以用水吸收,还可以观察CuCl2溶液的颜色。
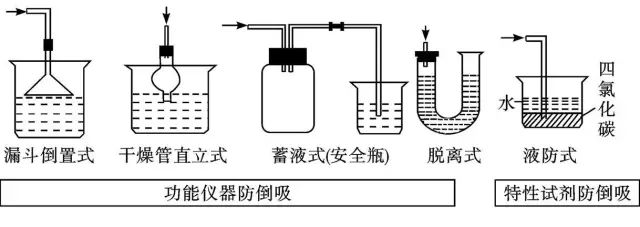
(1)倒立漏斗式:这种装置可以增大气体与吸收液的接触面积,有利于吸收液吸收气体。当易溶性气体被吸收液吸收时,导管内压强减小,吸收液上升到漏斗中。由于漏斗容积较大,导致烧杯中的液面下降,使漏斗口脱离烧杯中的液面,漏斗中的吸收液受自身重力的作用又流回烧杯内,从而防止吸收液倒吸。
(2)肚容式:当易溶于吸收液的气体被吸收液吸收后,导气管内压强减小,使吸收液倒吸进干燥管中,吸收液受自身重力的作用又流回烧杯内,从而防止吸收液倒吸。这种装置与倒立漏斗式的功能类似。
(3)蓄液式:当吸收液发生倒吸时,倒吸进来的吸收液被预先设置的蓄液装置贮存起来,以防止吸收液进入受热仪器或反应容器中。
(5)液防式:通过改变试剂的方法达到防倒吸的目的。如吸收HCl时,HCl不溶于四氯化碳而无法倒吸,HCl从四氯化碳中逸出进入水中而溶解。返回搜狐,查看更多







